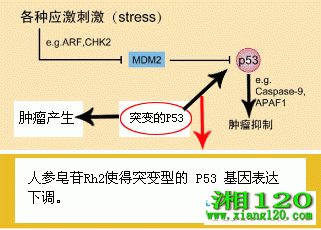
人参皂苷Rh2对肺腺癌细胞促凋亡作用
癌症治疗 2017-04-17 15:54癌症治疗www.aizhengw.cn
探讨人参单体Rh2对肺腺癌耐药A549 DDP细胞的促凋亡作用.人参皂苷Rh2能促使A549 DDP细胞凋亡,其可能是通过降低细胞的线粒体跨膜电位来诱导细胞凋亡。
化疗是治疗晚期患者的重要手段,临床上化疗失败的主要原因是细胞对抗癌药物产生耐药。寻找既能有效克服肿瘤细胞的耐药,毒副作用又小的抗癌药物,是目前临床上急需解决的问题。传统的中草药中不少药物因毒副作用小且有一定的抗肿瘤作用,而日益受到研究者们的关注。本研究拟探讨人参单体Rh2对肺腺癌A549DDP细胞的促凋亡作用。
1 人参单体Rh2对肺腺癌耐药A549 DDP细胞的促凋亡作用材料与方法
1.1 材料
1.1.1 细胞 肺腺癌A549细胞由中南大学细胞培养中心提供;A549DDP细胞由
中科院生物物理所生物大分子国家重点实验室提供。
1.1.2 药品 顺铂(cisplatin,DDP)购于山东齐鲁制药厂,人参单体Rh2由吉林
大学基础医学院生化研究室提供。
1.1.3 试剂 MTT、Hoechst33258、Rh—123均购自Sigma公司。其它试剂由中
南大学现代测试中心提供。
1.1.4 仪器 低温高速离心机、CO2细胞培养箱、荧光显微镜、酶标仪等由湘雅
医院中心实验室提供,流式细胞仪由湘雅医学院遗传实验室提供。
1.2 人参单体Rh2对肺腺癌耐药A549 DDP细胞的促凋亡作用方法
1.2.1 DDP或Rh2对细胞的抑制率 用MTT法计算DDP或Rh2对A549细胞和A549
DDP细胞的生长抑制率(IC)。经预实验选择0.1、1.0、10、20、50、100、
500μmol/L不同浓度,每种浓度设5个复孔。根据下列公式(1)计算顺铂
对细胞的半效抑制率(IC50),根据公式(2)计算耐药指数(RI)。将A549
DDP细胞分成2组,对照组细胞加生理盐水,实验组细胞加入能有效抑制
细胞的Rh2,作用48 h后进行后述指标检测。
细胞生长抑制率(IC)=
实验组A值-空白组A值
1- ×100% (1)
对照组A值-空白组A值
耐药细胞系的IC50
耐药指数(RI)= (2)
亲代细胞系的IC50
1.2.2 荧光染色观察细胞形态 细胞按上述实验分组药物干预后,消化细胞,
1000 r/min,离心10min,用PBS洗涤重悬,加入60μg/mL Hoechst33258,
约10 min后,荧光显微镜下观察,拍照;计数200个细胞,计算凋亡细胞
百分率。实验重复2次。
1.2.3 流式细胞仪检测细胞线粒体跨膜电位(Δψ) 细胞按上述实验分组药物
干预后,消化细胞,1000 r/min,离心10min,用PBS洗涤重悬,加入20μ
mol/L的Rh123染液,37℃避光染色30 min,PBS洗涤2次,重悬后在流式
细胞仪上检测细胞Δψ,激发波长488 nm,吸收波长525 nm。
1.2.4 统计处理 数据以均数±标准差(-x±s)表示,组间比较用单因素方差分
析,用Excel软件完成统计学处理。以P<0.05判断有统计学意义。
2 结果
2.1 DDP、Rh2对细胞的抑制率
DDP作用48h后,A549 DDP及A549细胞的IC50分别为325μmol/L、24μ
mol/L,RI为13.54,≤10μmol/L的Rh2对A549及A549 DDP细胞无明显抑制作用,IC<5 %(P>0.05);当Rh2≥20μmol/L时,对两种细胞有明显抑制作用(P<
0.05),且随着浓度的增加,Rh2对A549 DDP细胞的抑制率明显增强,见图1。
2.2荧光显微镜观察细胞核形态
Hoechst33258染色后,荧光显微镜下可见对照组的细胞核圆而大,细胞核形态正常,染色质分布均匀,表现为弥散均匀的荧光;细胞凋亡核占(6.13±0.98)%。实验组有大量固缩变形的细胞核,染色质浓缩、聚边,表现为浓染致密的荧光颗粒,细胞核缩小变形,有凋亡小体形成;细胞凋亡核占(59.46±1.22)%,与对照组比较,P<0.01。见图2。
对照组的A549 DDP细胞Δψ维持正常水平,而实验组的A549 DDP细胞Δψ明显降低,在正常峰之前出现一个Δψ明显降低的新的细胞亚群(图略),与对照组比较有显著性差异,P<0.01,见图3。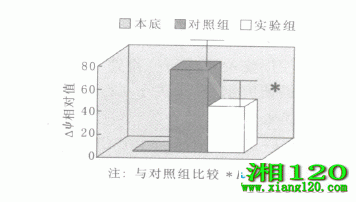
肿瘤耐药是目前临床上急需克服的难题,许多化学药物被证实具有抗癌作用,但这些药物在体内要达到体外抗癌实验的有效浓度需要的剂量太大,不能在临床中广泛应用。近年来学者们发现人参提取物、人参皂苷等可以直接杀伤肿瘤细胞。Choi等[1]研究了人参皂苷包括总苷、PDG、PTG、Rb1、Rb2、Rc、Rg1、Rc能否提高两种急性淋巴细胞性白血病细胞(AML—2/D100细胞和AML—2/DX100细胞)的化疗敏感性和药物积累,发现PTG对两种细胞均有毒性。Yun[2]则通过流行病学研究,发现高丽参可预防和抵抗非器官特异性癌症,食用人参者患、肺癌的相关风险率(RR)降低,而这种预防和抗癌特性主要是由于Rg3、Rg5、Rh2的作用。Yun等[3]研究了包括Rh2在内的4种人参皂角苷的抗癌效果,发现Rh2是人参中抗癌的有效成分,它有降低肺癌发生率的倾向性。本实验结果显示,A549 DDP细胞虽然对顺铂的耐药性显著强于敏感的A549细胞,大于10μmol/L的Rh2对这两种细胞均有明显抑制作用,且这种逆转作用呈剂量依赖性。Hoechst33258染色后,对照组细胞核染色质分布均匀,荧光分布正常,实验组中,A549 DDP细胞核染色质聚集增浓,荧光团块状分布,并有特征性凋亡小体出现。说明Rh2能诱导A549DDP细胞凋亡,与文献报道一致。
发掘高效低毒的抗癌剂,中草药具有极大的优势,应用前景广阔,但中药药理作用广泛,药物成分复杂,很多中药抗癌机制不明确。Fei等[4]发现Rh2能诱导恶性黑色素瘤A375—S2细胞凋亡而抑制其增殖,且呈浓度和时间依赖性,其诱导凋亡是由Caspase—8和Caspase—3通路实现的,但他认为其他凋亡通路也可能与Rh2诱导凋亡有关。周桂华等[5]报道Rh2对PC—3M细胞有明显的抑制作用,而且随着Rh2浓度的增加,其对PC—3M细胞的抑制作用也增强,Rh2的这种抑制作用可能是由于其抑制了肿瘤细胞的DNA复制和转录,使肿瘤细胞的增殖减慢或停止。Δψ的崩解是细胞凋亡的特异性早期指标之一,Δψ对维持线粒体功能具有重要意义,一旦线粒体跨膜电位耗散,细胞就会释放促凋亡物质等一系列变化,进入不可逆的凋亡过程[6]。本研究中,对照组的细胞Δψ维持正常水平,而实验组的细胞Δψ明显降低,与对照组比较有显著性差异(P<0.01),说明Rh2对A549 DDP细胞的促凋亡作用可能是通过降低乃至崩解细胞的Δψ来实现的。对于Rh2是如何由线粒体凋亡通路最终引起细胞凋亡的,作者将作后续报道。
作者
胡 硕1,胡成平1,梁昌华1,黄柏英2
(1.中南大学湘雅医院,湖南长沙410008;2.中南大学细胞培养中心,湖南长沙410008)
参考文献:
[1] Choi CH, Kang G, Min YD.Reversal of P-glycoprotein-mediated multidrug resistance by protopanaxatriol ginsenosides from Korean red ginseng[J].Planta Med,2003,69(3):235—240.
[2] Yun TK. Experimental and epidemiological evidence on nonorgan specific cancer preventive effect ofKorean ginseng and identificationof active compounds[J]. Mutat Res,2003,523—524:63—74.
[3] Yun TK,Lee YS,Lee YH.Anticarcinogenic effect of panax ginseng C.A. Meyer and identification of active compounds [J].J Korean Med Sci,2001, 16 supopl:16—18.
[4] Fei XF,Wang BX,Tashiros,et al.Apoptotic effect of ginsenoside Rh2 on human malignant melanoma A375—S2cells[J].Acta Pharmacol Sin,
2002,23(4):315—322.
[5] 周桂华,孟 艳,李 扬,等.人参单体皂苷Rh2对细胞株抑制效应研究[J].白求恩医科大学学报,2001,27(6):595—597.
[6] Hengartner M O. The biochemistry of apoptosis[J]. Nature,
2000, 407(12): 770—776.

1.1 材料
1.1.1 细胞 肺腺癌A549细胞由中南大学细胞培养中心提供;A549DDP细胞由
中科院生物物理所生物大分子国家重点实验室提供。
1.1.2 药品 顺铂(cisplatin,DDP)购于山东齐鲁制药厂,人参单体Rh2由吉林
大学基础医学院生化研究室提供。
1.1.3 试剂 MTT、Hoechst33258、Rh—123均购自Sigma公司。其它试剂由中
南大学现代测试中心提供。
1.1.4 仪器 低温高速离心机、CO2细胞培养箱、荧光显微镜、酶标仪等由湘雅
医院中心实验室提供,流式细胞仪由湘雅医学院遗传实验室提供。
1.2 人参单体Rh2对肺腺癌耐药A549 DDP细胞的促凋亡作用方法
1.2.1 DDP或Rh2对细胞的抑制率 用MTT法计算DDP或Rh2对A549细胞和A549
DDP细胞的生长抑制率(IC)。经预实验选择0.1、1.0、10、20、50、100、
500μmol/L不同浓度,每种浓度设5个复孔。根据下列公式(1)计算顺铂
对细胞的半效抑制率(IC50),根据公式(2)计算耐药指数(RI)。将A549
DDP细胞分成2组,对照组细胞加生理盐水,实验组细胞加入能有效抑制
细胞的Rh2,作用48 h后进行后述指标检测。
细胞生长抑制率(IC)=
实验组A值-空白组A值
1- ×100% (1)
对照组A值-空白组A值
耐药细胞系的IC50
耐药指数(RI)= (2)
亲代细胞系的IC50
1.2.2 荧光染色观察细胞形态 细胞按上述实验分组药物干预后,消化细胞,
1000 r/min,离心10min,用PBS洗涤重悬,加入60μg/mL Hoechst33258,
约10 min后,荧光显微镜下观察,拍照;计数200个细胞,计算凋亡细胞
百分率。实验重复2次。
1.2.3 流式细胞仪检测细胞线粒体跨膜电位(Δψ) 细胞按上述实验分组药物
干预后,消化细胞,1000 r/min,离心10min,用PBS洗涤重悬,加入20μ
mol/L的Rh123染液,37℃避光染色30 min,PBS洗涤2次,重悬后在流式
细胞仪上检测细胞Δψ,激发波长488 nm,吸收波长525 nm。
1.2.4 统计处理 数据以均数±标准差(-x±s)表示,组间比较用单因素方差分
析,用Excel软件完成统计学处理。以P<0.05判断有统计学意义。
2 结果
2.1 DDP、Rh2对细胞的抑制率
DDP作用48h后,A549 DDP及A549细胞的IC50分别为325μmol/L、24μ
mol/L,RI为13.54,≤10μmol/L的Rh2对A549及A549 DDP细胞无明显抑制作用,IC<5 %(P>0.05);当Rh2≥20μmol/L时,对两种细胞有明显抑制作用(P<
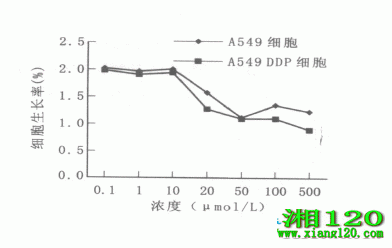
0.05),且随着浓度的增加,Rh2对A549 DDP细胞的抑制率明显增强,见图1。
2.2荧光显微镜观察细胞核形态
Hoechst33258染色后,荧光显微镜下可见对照组的细胞核圆而大,细胞核形态正常,染色质分布均匀,表现为弥散均匀的荧光;细胞凋亡核占(6.13±0.98)%。实验组有大量固缩变形的细胞核,染色质浓缩、聚边,表现为浓染致密的荧光颗粒,细胞核缩小变形,有凋亡小体形成;细胞凋亡核占(59.46±1.22)%,与对照组比较,P<0.01。见图2。

图1 Rh2对细胞生长的抑制曲线
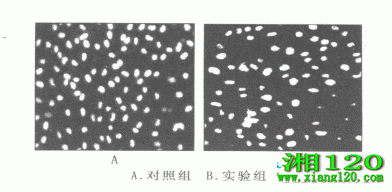

图2 细胞荧光染色(×200)
2.3 流式细胞仪检测细胞线粒体跨膜电位对照组的A549 DDP细胞Δψ维持正常水平,而实验组的A549 DDP细胞Δψ明显降低,在正常峰之前出现一个Δψ明显降低的新的细胞亚群(图略),与对照组比较有显著性差异,P<0.01,见图3。

图3 Δψ相对值直方图
3 人参皂苷RH2抗癌作用讨论肿瘤耐药是目前临床上急需克服的难题,许多化学药物被证实具有抗癌作用,但这些药物在体内要达到体外抗癌实验的有效浓度需要的剂量太大,不能在临床中广泛应用。近年来学者们发现人参提取物、人参皂苷等可以直接杀伤肿瘤细胞。Choi等[1]研究了人参皂苷包括总苷、PDG、PTG、Rb1、Rb2、Rc、Rg1、Rc能否提高两种急性淋巴细胞性白血病细胞(AML—2/D100细胞和AML—2/DX100细胞)的化疗敏感性和药物积累,发现PTG对两种细胞均有毒性。Yun[2]则通过流行病学研究,发现高丽参可预防和抵抗非器官特异性癌症,食用人参者患、肺癌的相关风险率(RR)降低,而这种预防和抗癌特性主要是由于Rg3、Rg5、Rh2的作用。Yun等[3]研究了包括Rh2在内的4种人参皂角苷的抗癌效果,发现Rh2是人参中抗癌的有效成分,它有降低肺癌发生率的倾向性。本实验结果显示,A549 DDP细胞虽然对顺铂的耐药性显著强于敏感的A549细胞,大于10μmol/L的Rh2对这两种细胞均有明显抑制作用,且这种逆转作用呈剂量依赖性。Hoechst33258染色后,对照组细胞核染色质分布均匀,荧光分布正常,实验组中,A549 DDP细胞核染色质聚集增浓,荧光团块状分布,并有特征性凋亡小体出现。说明Rh2能诱导A549DDP细胞凋亡,与文献报道一致。
发掘高效低毒的抗癌剂,中草药具有极大的优势,应用前景广阔,但中药药理作用广泛,药物成分复杂,很多中药抗癌机制不明确。Fei等[4]发现Rh2能诱导恶性黑色素瘤A375—S2细胞凋亡而抑制其增殖,且呈浓度和时间依赖性,其诱导凋亡是由Caspase—8和Caspase—3通路实现的,但他认为其他凋亡通路也可能与Rh2诱导凋亡有关。周桂华等[5]报道Rh2对PC—3M细胞有明显的抑制作用,而且随着Rh2浓度的增加,其对PC—3M细胞的抑制作用也增强,Rh2的这种抑制作用可能是由于其抑制了肿瘤细胞的DNA复制和转录,使肿瘤细胞的增殖减慢或停止。Δψ的崩解是细胞凋亡的特异性早期指标之一,Δψ对维持线粒体功能具有重要意义,一旦线粒体跨膜电位耗散,细胞就会释放促凋亡物质等一系列变化,进入不可逆的凋亡过程[6]。本研究中,对照组的细胞Δψ维持正常水平,而实验组的细胞Δψ明显降低,与对照组比较有显著性差异(P<0.01),说明Rh2对A549 DDP细胞的促凋亡作用可能是通过降低乃至崩解细胞的Δψ来实现的。对于Rh2是如何由线粒体凋亡通路最终引起细胞凋亡的,作者将作后续报道。
作者
胡 硕1,胡成平1,梁昌华1,黄柏英2
(1.中南大学湘雅医院,湖南长沙410008;2.中南大学细胞培养中心,湖南长沙410008)
参考文献:
[1] Choi CH, Kang G, Min YD.Reversal of P-glycoprotein-mediated multidrug resistance by protopanaxatriol ginsenosides from Korean red ginseng[J].Planta Med,2003,69(3):235—240.
[2] Yun TK. Experimental and epidemiological evidence on nonorgan specific cancer preventive effect ofKorean ginseng and identificationof active compounds[J]. Mutat Res,2003,523—524:63—74.
[3] Yun TK,Lee YS,Lee YH.Anticarcinogenic effect of panax ginseng C.A. Meyer and identification of active compounds [J].J Korean Med Sci,2001, 16 supopl:16—18.
[4] Fei XF,Wang BX,Tashiros,et al.Apoptotic effect of ginsenoside Rh2 on human malignant melanoma A375—S2cells[J].Acta Pharmacol Sin,
2002,23(4):315—322.
[5] 周桂华,孟 艳,李 扬,等.人参单体皂苷Rh2对细胞株抑制效应研究[J].白求恩医科大学学报,2001,27(6):595—597.
[6] Hengartner M O. The biochemistry of apoptosis[J]. Nature,
2000, 407(12): 770—776.
上一篇:肺癌手术治疗的方案
下一篇:癌症专家解析肺癌治疗
